El término resistencia en Nematología describe exclusivamente el efecto de la planta huésped sobre la reproducción del nematodo. Así, se considera que una planta es resistente cuando inhibe la reproducción del nematodo respecto a la reproducción alcanzada en una planta susceptible (COOK Y EVANS, 1987). Esta inhibición puede ser total o parcial. Por el contrario, el término tolerancia no es un tipo de resistencia y hace referencia al daño que sufre la planta huésped. Una planta tolerante sufre poco daño incluso cuando está infectada por niveles altos del nematodo.
El tomate (Lycopersicon esculentum) es susceptible a todas las especies de Meloidogyne que comúnmente se encuentran en España (RODRÍGUEZ RODRÍGUEZ, 1984 Y 1989, CENIS, 1987, MILLÁN DE AGUIRRE, 1989, SORRIBAS Y VERDEJO-LUCAS, 1994 Y 1999, ESCUER et al., 1996, ORNAT Y VERDEJO-LUCAS, 1999, ORNAT et al., 1999). La mayor incidencia del nematodo ha coincidido en el tiempo con la intensificación de los cultivos hortícolas y el desarrollo de los cultivos protegidos bajo cubierta (ORNAT et al., 1997).
En la actualidad, el control de Meloidogyne se basa principalmente en la utilización de fumigantes del suelo y nematicidas. No obstante, la retirada del bromuro de metilo, las prohibiciones que aplican las normativas de Producción Integrada en cuanto a uso de fumigantes del suelo y nematicidas, y las restricciones que imponen los consumidores, así como sus efectos negativos para el medio ambiente, han propiciado el desarrollo y evaluación de otros métodos o técnicas para el control del nematodo.
El uso de tomates portadores del gen Mi de resistencia a Meloidogyne es una táctica de manejo ideal puesto que no comporta riesgos para la salud o el medio ambiente, ni requiere gastos adicionales en cuanto al coste de las plántulas o manejo del cultivo. Existen numerosos cultivares de tomate (híbridos F1) que portan el gen Mi de resistencia en el mercado. El gen Mi proporciona resistencia, pero no-inmunidad, a M. incognita, M. javanica y M. arenaria (ROBERTS Y THOMASON, 1989) reduciendo considerablemente la tasa de reproducción del nematodo (ORNAT Y VERDEJO-LUCAS, 1999, SORRIBAS Y VERDEJO-LUCAS, 1999). Las plantas resistentes no sufren pérdidas significativas de producción en suelos infestados y favorecen el desarrollo y producción del cultivo susceptible siguiente (ORNAT et al., 1997).
Asimismo, comportan un beneficio económico a corto como a largo plazo en comparación con el bromuro de metilo (SORRIBAS et al., 2002). El gen Mi además, confiere resistencia a Macrosiphum euphorbiae (ROSSI et al., 1998) y a los biotipos Q (NOMBELA et al., 2001) y B (JIANG et al., 2001) de Bemisisa tabac .
El injerto es una técnica tradicionalmente utilizada en agricultura con diversos fines entre los que se incluye proporcionar resistencia o tolerancia a patógenos del suelo, incrementar el vigor, equilibrar las producciones, re-utilizar suelos infestados sin necesidad de recurrir a la desinfestación de los mismos y cultivar en suelos no aptos para la variedad injertada.
El principal objetivo de esta técnica en hortalizas es contrarrestar el daño causado por enfermedades del suelo tales como las causadas por Fusarium oxysporum, Ralstonia solanacearum y nematodos, las cuales llegan a producirse por el cultivo continuado de las hortalizas en un mismo suelo. En general, el injerto proporciona mayor vigor a la planta y se asume que este vigor aumenta la tolerancia de la planta a los patógenos, aunque el efecto también se atribuye a una mayor absorción de agua y nutrientes por parte de las raíces del injerto (LEE, 1994).
En España, el injerto de hortalizas se ha convertido en una técnica habitual para el manejo de ciertas enfermedades del suelo siendo la sandía el ejemplo más paradigmático para combatir Fusarium oxysporum f. sp. niveum en suelos infestados (MIGUEL GÓMEZ, 1995). Esta técnica se ha utilizado en tomate para los tipos Cherry y Marmande que no poseen resistencias específicas a patógenos y para la prevención de Pyrenochaeta lycopersici causante del "corky root". En los últimos años, su uso ha incrementado considerablemente motivado por la aparición de una alteración de etiología desconocida llamada el "colapso" del tomate que se produce en cultivos de invierno (MIGUEL, 2002a).
Los porta-injertos que se utilizan en tomate son Lycopersicon esculentum e híbridos ínterespecíficos de L. esculentum x L. hirsutum que proporcionan resistencia a varios patógenos y mayor vigor a la planta, lo que permite cultivar tomates en condiciones en las que no es posible cultivarlos sin injertar (MIGUEL GÓMEZ, 1995). El uso de la técnica del injerto en tomate se ha propuesto como una alternativa al bromuro de metilo para la producción de tomate en España (MIGUEL, 2002b).
El objetivo de este trabajo fue realizar un estudio comparativo de la eficacia del porta-injerto de tomate SC 6301 frente al cultivar portador del gen Mi de resistencia Monika para el manejo de Meloidogyne en tomate mediante la valoración de la reproducción del nematodo y la producción del cultivo en invernadero.
Materiales y métodos
El ensayo se realizó en un invernadero de hierro galvanizado con cubierta de polietileno ubicado en Cabrils, Barcelona. El suelo tenía una textura franco arenosa y un pH de 8,1. Meloidogyne javanica era el único nematodo fitoparásito que infestaba el suelo del invernadero. Los tratamientos fueron:
a) tomate resistente portador del gen Mi cv Monika,
b) tomate susceptible cv Durinta injertado sobre Lycopersicon esculentum SC6 301, y
c) tomate susceptible cv Durinta sin injertar que se utilizó como control de referencia.
Las resistencias incorporadas en estos tomates y sus principales características se describen en la Tabla 1. El diseño experimental fue bloques estratificados al azar con cinco repeticiones por tratamiento. Cada parcela elemental (repetición) consistía de dos filas con seis plantas cada una. La distancia entre plantas era de 40 cm en la fila y de 70 cm entre filas, resultando un marco de plantación de 2,9 plantas /m2. Las plantas injertadas se guiaron a dos tallos. El cultivo de tomate se inició el 4 de marzo y finalizó el 12 julio de 2002.


Tabla 1. Resistencias y principales características de los cultivares de tomate y del porta-injerto utilizados en el estudio.
Tabla 2. Ventajas y limitaciones que ofrecen los cultivares portadores del gen Mi de resistencia y los porta-injertos de tomate respecto a cultivares susceptibles para el manejo del nematodo Meloidogyne en suelos infestados.
Determinación de los niveles del nematodo. Antes de iniciar el ensayo se tomaron muestras compuestas de suelo de cada una de las parcelas elementales para determinar el número de juveniles de segundo estadio (J2) presentes en el suelo (población inicial), siendo los niveles promedio 225 ± 150 juveniles por 250 cm3 suelo (media ± desviación estándar). Al finalizar el cultivo, se recolectaron muestras de suelo para determinar la población final de M. javanica.
Cada muestra individual consistía de cinco submuestras tomadas de los primeros 30 cm del suelo con un barreno de media caña (2,5 cm de diámetro). El suelo de cada muestra se mezcló para homogenizarlo y los nematodos se extrajeron de una submuestra de 500 cm3 de suelo utilizando bandejas tipo Baermann. Los juveniles que migraban al agua se recolectaron una semana más tarde, se concentraron en un tamiz de 25mm y se cuantificaron. El número de J2 se expresa por 250 cm3 de suelo.
Estimación del daño. Se determinó el índice de agallas basado en una escala de 0 a 10, donde 0 = sistema radicular sin agallas, y 10 = plantas y raíces muertas (ZECK, 1971). Después de realizar el muestreo para determinar la población final, se arrancaron ocho plantas de tomate por repetición (las mismas que se utilizaron para evaluar la producción) y se determinó el índice de agallas.
Las raíces de las ocho plantas de cada repetición se lavaron para eliminar los restos de tierra adherida, mezclaron, cortaron y utilizaron para realizar la extracción de huevos de M. javanica. Los huevos del nematodo se extrajeron de dos submuestras de 10 gramos de raíces cada una mediante maceración de las mismas en una solución al 0,5% de NaOCl durante 10 minutos (HUSSEY Y BARKER, 1973). El número de huevos se expresa por gramo de raíz.
Producción de tomate. Se recolectaron los frutos de ocho plantas por repetición conforme maduraban hasta un total de seis pomos. Los frutos se recolectaron semanalmente, se pesaron, contaron y se estimó el peso medio de los mismos. La producción acumulada se expresa en kilogramos por m2.
Análisis estadístico. Los datos sobre el número de nematodos en suelo, y huevos por gramo de raíz se transformaron a [log10 (x + 1)], y sometieron a análisis de la varianza utilizando el procedimiento GLM del SAS. Las medias se separaron mediante el método de la Mínimas Diferencias Significativas (LSD) (P<0,05). Los datos sobre producción de tomate se sometieron a análisis de la varianza y las medias se separaron por el método de LSD.
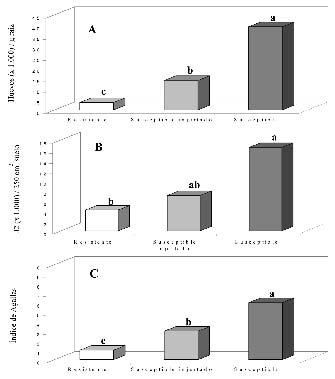
Figura 1. Reproducción del nematodo Meloidogyne javanica en tomate portador del gen Mi de resistencia cv Monika y en el tomate susceptible cv. Durinta injertado sobre Lycopersicon esculentum SC 6301 o sin injertar en un invernadero infestado por el nematodo. A) Número de huevos por gramo de raíz. B) Número de juveniles (J2) por 250 cm3 de suelo al final del cultivo. C) Índice de agallas en una escala del 0 (sin agallas) a 10 (planta muerta). Cada valor es promedio de cinco repeticiones. Letras distintas sobre las columnas indican diferencias estadísticas de acuerdo con la Prueba de las Mínimas Diferencias Significativas (P<0,05).
Resultados
La reproducción de M. javanica fue significativamente menor (P<0,05) en el tomate resistente que en el porta-injerto SC 6301, y en este, la reproducción fue a su vez menor (P< 0,05) que en el tomate susceptible.
Así, el número de huevos por gramo de raíz en el tomate resistente y en el porta- injerto constituía un 9% y un 35% de los producidos en el tomate susceptible (100%), respectivamente. (Figura 1A). Los juveniles en el suelo de las parcelas plantadas con tomate resistente y con el porta-injerto constituían el 25% y el 42% de los alcanzados en el tomate susceptible (100%), respectivamente (Figura 1B). El índice de agallas de los tomates resistentes fue 1 (Figura 1C), que de acuerdo con la escala utilizada significaba que las plantas tenían muy pocas agallas, eran muy pequeñas y solo se detectaban cuando se examinaba la raíz con detenimiento (Figura 2A).
El índice de agallas en el porta-injerto fue 3 equivalente a numerosas agallas pequeñas, algunas de ellas juntas formando rosario (Figura 2B), mientras que las raíces del tomate susceptible mostraban un índice de 6, equivalente al 50% de las raíces severamente agalladas, necróticas y no funcionales (Figura 2C). La producción acumulada de las plantas del injerto fue superior (P< 0,05) a la de los cultivares de tomates sin injertar ya fueran estos resistentes o susceptibles al nematodo (Figura 3A).
El número de frutos producidos por planta en el injerto fue el doble que en las plantas sin injertar independientemente de su resistencia o susceptibilidad al nematodo (Figura 3B). Sin embargo, el peso medio de los frutos del cultivar resistente Monika fue mayor (P< 0,05) que el del cultivar susceptible Durinta estuviese o no injertado (Figura 3C).
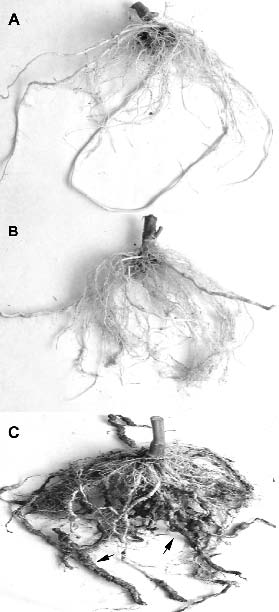
Figura 2. Sistemas radicales de plantas de tomate cultivadas en suelo infestado por Meloidogyne javanica en un invernadero. A) Raíz de tomate cv. Monika portador del gen Mi de resistencia con índice deagallas = 1 (las agallas no se aprecian en la foto). B) Raíz del porta-injerto de Lycopersicon esculentum SC 6301 con índice de agallas = 3 (las flechas señalan agallas individuales y en rosario). C) Raíz de tomatesusceptible cv. Durinta con índice de agallas = 6 (las flechas señalan agallas en rosario y raícesnecróticas no funcionales).
Discusión
Los resultados de este trabajo confirman otros anteriores sobre la eficacia de los cultivares de tomate portadores del gen Mi de resistencia para el manejo de Meloidogyne en el nordeste peninsular (ORNAT et al., 1997). El cultivar resistente Monika reducía considerablemente el inóculo potencial del nematodo (huevos) que quedaba tras su cultivo en el invernadero (Figura 1A).
Este inóculo potencial fue un 91% inferior al que dejaba el tomate susceptible y la producción del tomate resistente fue un 23% superior a la del tomate susceptible (Figura 3). El porta-injerto SC 6301 reducía 2,8 veces la producción de huevos del nematodo respecto al cultivar susceptible sin injertar, pero esta reducción era, sin embargo, mucho menor que la obtenida con el tomate resistente (11 veces menor). Así, el nivel de inóculo potencial del nematodo tras el cultivo del tomate injertado era un 294% superior al que el que dejaba el tomate resistente, pero un 65% inferior al dejado por el tomate susceptible. Por tanto, la eficacia del porta-injerto sobre la reproducción de Meloidogyne era intermedia entre el tomate resistente y el susceptible sin injertar.
El índice de agallas de las raíces del porta-injerto era intermedio entre el tomate resistente y el susceptible. De estos resultados se deduce que el porta-injerto SC 6301 será útil como táctica de control a corto plazo. En ensayos realizados en Valencia, el porta- injerto SC 6301 reducía la incidencia de nema todos respecto a la planta sin injertar, pero no se evaluó el efecto sobre la reproducción del nematodo (MIGUEL, 2002a). Ros et al., (2002) han demostrado la eficacia de la técnica del injerto en pimiento para el manejo de M. incognita a corto plazo, pero también han demostrado que esta eficacia se va reduciendo cuando se realiza el cultivo continuado de la planta injertada en el mismo suelo durante campañas sucesivas, y esto se debe al acumulo progresivo del inóculo potencial del nematodo dejado tras su cultivo.
La producción y número de frutos por tallo del tomate Durinta fueron similares tanto en el injerto como en la planta sin injertar siendo la conducción a dos tallos la responsable de la duplicación de la producción. El coste del tomate injertado fue 0,578 ? /planta, mientras que el del tomate resistente fue 0,148 ? /planta y el del susceptible 0,155 ?/planta, por tanto, un incremento de producción del injerto que superare la diferencia de precio de la planta compensará el coste mayor de la misma. Precisamente, los injertos se conducen a dos, tres, o incluso cuatro tallos para compensar dicho coste (MIGUEL, 2002a). Las ventajas y limitaciones que ofrecen los cultivares portadores del gen Mi de resistencia y el porta-injerto de tomate para el manejo de Meloidogyne se exponen en la Tabla 2.
Así, los cultivares resistentes reducen considerablemente los niveles de Meloidogyne ofreciendo una protección muy alta contra el nematodo a corto, medio y largo plazo. No obstante, su aceptación es relativa por parte de los agricultores por diversas razones entre las que se incluyen la calidad del fruto, la demanda de frutos con características muy específicas por ciertos mercados, y en ocasiones, el menor rendimiento de las plantas resistentes en ausencia del nematodo. Una limitación importante de estos cultivares es la rotura de la resistencia por efecto de la temperatura que se produce cuando las temperaturas del suelo sobrepasan los 30ºC.
Esta limitación puede comprometer la utilidad de los tomates resistentes en determinadas climatologías. En el nordeste peninsular, sin embargo, se ha comprobado la eficacia de los mismos en invernadero (SORRIBAS et al., 2002) donde las temperaturas del suelo no sobrepasan los 30ºC durante el cultivo del tomate (VERDEJO-LUCAS et al. 2003). Una de las principales ventajas del porta-injerto de tomate es que permiten cultivar variedades muy cotizadas por el consumidor y mercado (por ejemplo, los tomates Raf, Valenciano, Montserrat, etc.) en suelos infestados por el nematodo u otros patógenos obteniendo un buen rendimiento. Sin embargo, los porta-injertos tienen la limitación de que sólo reducen parcialmente los niveles poblacionales del nematodo.
Por ello, será preciso combinar el uso del porta-injerto con otros métodos de control para contrarrestar el acumulo de inóculo que se produce tras su cultivo. La técnica del injerto también será de utilidad en situaciones en las que el nematodo co-existe con otros hongos patógenos dando lugar a interacciones sinérgicas, puesto que los patrones que se utilizan para el injerto suelen presentar resistencia a varias enfermedades al igual que sucede con los cultivares portadores del gen Mi.
El estudio comparativo realizado en este trabajo habrá que hacerlo extensivo a otros porta-injertos de L. esculentum y de L. esculentum x L. hirsutum para determinar su eficacia relativa en nuestras condiciones. De los resultados expuestos se deriva que injertar la variedad deseada en cultivares de tomate portadores del gen Mi podría ser doblemente beneficioso pues se conseguiría por un lado, un control eficaz del nematodo, y por otro, cultivar la variedad deseada en suelos infestados por el nematodo. Esta posibilidad se está evaluando en la actualidad.
Agradecimientos: Este trabajo ha sido financiado por el Ministerio de Ciencia y Tecnología, proyecto CICYT AGF99-0560.
BIBLIOGRAFÍA
CENIS, J. L. 1987. Occurrence of the root-knot nematode, Meloidogyne spp.in the south-east of Spain. Abstr. 7th Congress of Mediterranean Phytopathological Union. Granada.
COOK R., EVANS, K. 1987. Resistance and Tolerance. Pp: 179-231. En: Principles and Practice of nematode control in crops. R. H. Brown y B. R. Kerry (eds). Academic Press. Australia. .
ESCUER, M., RODRÍGUEZ, M. D., RODRÍGUEZ, M. P., LASTRES, J., BELLO, A. 1996. Incidencias de Meloidogyne en cultivos hortícolas de Almería. Abstr. VIII Congreso Nacional de Fitopatología. Córdoba.
HUSSEY, R.S., BARKER, K. 1973. A comparison of methods of collecting inocula of Meloidogyne spp. including a new technique. Plant Disease Reporter 57: 1025-1028.
JIANG, Y. X., NOMBELA, G., MUÑIZ, M. 2001. Análisis by DC-EPG of the resistance to Bemisia tabaci on an Mi-tomato line. Entomologia Experimentalis et Applicata. 99: 259-302.
LEE, J-M. 1994. Cultivation of grafted vegetables I. Current status, grafting methods, and benefits. HortScience 29: 235-239.
MILLÁN DE AGUIRRE, J. R. 1989. Especies del género Meloidogyne presentes en los cultivos del País Vasco. Abstr V Congreso Nacional de Fitopatología Badajoz.
MIGUEL GÓMEZ, A. 1995. El injerto en hortalizas. Pp 19-5. II Jornadas sobre semillas y semilleros hortícolas. Colección Congresos y Jornadas 35/96. Junta de Andalucía. Consejería de Agricultura y Pesca.
MIGUEL, A. 2002a. El injerto como método de prevención de enfermedades de hortalizas. Phytoma 135: 167-171.
MIGUEL, A 2002b. Grafting as a non-chemical alternative to methyl bromide for tomatoes in Spain. Pp. 268-270. Proceedings of International Conference on Alternatives to methyl bromide. Seville, Spain 5-8 March 2000.
NOMBELA, G., BEITIA, F., MUÑÍZ, M. 2001. A differential interaction study of Bemisia tabaci Q-biotype on commercial tomato varieties with or without the Mi resistance gene, and comparative host responses with the B-biotype. Entomologia Experimentalis et Applicata. 98: 339-344.
ORNAT, C., Y VERDEJO-LUCAS, S. 1999. Distribución y densidad de población de Meloidogyne spp. en cultivos hortícolas de la comarca del Maresme (Barcelona). Investigación Agraria. 14:191-201.
ORNAT, C., VERDEJO-LUCAS, S. Y SORRIBAS, F. J. 1997. Effect of the previous crop on population densities of Meloidogyne javanica and yield of cucumber. Nematropica. 27: 85-90.
ORNAT, C., VERDEJO LUCAS, S., SORRIBAS, F. J., SANTORO, I. 1999. El nematodo Meloidogyne en los cultivos hortícolas de los invernaderos de Almería. Phytoma España 106: 27-34.
ROBERTS, P. A., THOMASON, I. J. 1989. A review of variability in four Meloidogyne pp. measured by reproduction on several hosts including Lycopersicon. Agricultural Zool. Review 3: 225-252.
RODRÍGUEZ RODRÍGUEZ, R. 1984. El género Meloidogyne en Canarias. 1. Rastreo geográfico preliminar y especies encontradas. Xoba 4: 41-51.
RODRÍGUEZ RODRÍGUEZ, R. 1989. Los nematodos del género Meloidogyne en hortícolas, biología, daños y control. Cuadernos de Fitopatología 20: 95-101.
ROS, C., GUERRERO, M. M., GUIRAO, P., LACASA, A., MARTÍNEZ, M. A., TORRES, J. BARCELO, N., GONZÁLEZ, A. 2002. Response of pepper stocks to Meloidogyne incognita in glasshouses in the southeast of Spain. Nematology 4: 237.
ROSSI, M., GOGGIN, F. L., MILLIGAN, S. B., KALOSHIAN, I., ULLMAN, D. E., WILLIAMSON, V. M. 1998. The nematode resistance gene Mi of tomato confers resistance against the potato aphid. Proceedings of the National Academy of Sciences, USA. 95: 9750-9754.
SORRIBAS, F. J., VERDEJO-LUCAS, S. 1994. Survey of Meloidogyne spp. in tomato production fields of Baix Llobregat County, Spain. Journal of Nematology 26: 731-736.
SORRIBAS, F. J., VERDEJO-LUCAS, S. 1999. Capacidad parasitaria de Meloidogyne ssp. En cultivares de tomate resistente. Investigación Agraria: Producción Vegetal 14: 237-247.
SORRIBAS, F. J,. ORNAT, C., VERDEJO-LUCAS, S., GALEANO, M. 2002. Economic impact of resistant tomato cultivars as an alternative to methyl bromide to control Meloidogyne javanica. Nematology 4: 298.
VERDEJO-LUCAS, S., SORRIBAS, F. J,. ORNAT, C., GALEANO, M. 2003. Evaluating Pochonia chlamydosporia in a double cropping system of lettuce and tomato in plastic houses infested with Meloidogyne javanica. Plant Pathology Aceptado marzo 2003.
ZECK, W. M. 1971. A rating scheme for field evaluation of root-knot nematode infestations. Pflanzenschtz-Nachrichten. Bayer AG. 24: 141-144.













