Es un hecho que la superficie agrícola destinada al cultivo sin suelo es cada vez mayor en nuestro país, y más concretamente en la zona del Sudeste (actualmente la superficie estimada es de 4.800 hectáreas), donde los sistemas hortícolas alcanzan su mayor grado de tecnificación. Estos sistemas de cultivo sin suelo, apoyados en sustratos inertes (de origen orgánico o inorgánico) o en soluciones nutritivas líquidas (NFT, NGS), configuran un ambiente en la zona de asiento de las plantas diferente al de un patosistema tradicional, al quedar sustituido el suelo por aquellos sustratos o soluciones. Es esta modificación del ambiente, una de las razones esgrimidas por algunos técnicos y agricultores para motivar la transición a cultivo sin suelo desde explotaciones en las que los problemas de origen telúrico se presentan irremediables. Se podría pensar que los sustratos y soluciones nutritivas, al ser inertes, no irían a constituir una fuente de inóculo, por impedir el crecimiento saprofítico de los microorganismos patógenos. Además, estos sustratos llegan esterilizados o desinfectados a la explotación, lo que reforzaría este pensamiento.
Nada más lejos de la realidad. La experiencia nos enseña cómo los problemas fitopatológicos persisten en los sistemas de cultivo sin suelo.
A lo largo de este artículo comprobaremos cómo la modificación del ambiente (uno de los vértices del triángulo de la enfermedad propuesto por Vanderplank) no conduce a la solución del problema, sino que construye un nuevo triángulo de la enfermedad con vértices distintos.
Un nuevo patosistema
Es un hecho que la superficie agrícola destinada al cultivo sin suelo es cada vez mayor en nuestro país, y más concretamente en la zona del Sudeste (actualmente la superficie estimada es de 4.800 hectáreas), donde los sistemas hortícolas alcanzan su mayor grado de tecnificación. Estos sistemas de cultivo sin suelo, apoyados en sustratos inertes (de origen orgánico o inorgánico) o en soluciones nutritivas líquidas (NFT, NGS), configuran un ambiente en la zona de asiento de las plantas diferente al de un patosistema tradicional, al quedar sustituido el suelo por aquellos sustratos o soluciones.
Es esta modificación del ambiente, una de las razones esgrimidas por algunos técnicos y agricultores para motivar la transición a cultivo sin suelo desde explotaciones en las que los problemas de origen telúrico se presentan irremediables. Se podría pensar que los sustratos y soluciones nutritivas, al ser inertes, no irían a constituir una fuente de inóculo, por impedir el crecimiento saprofítico de los microorganismos patógenos. Además, estos sustratos llegan esterilizados o desinfectados a la explotación, lo que reforzaría este pensamiento. Nada más lejos de la realidad.
La experiencia nos enseña cómo los problemas fitopatológicos persisten en los sistemas de cultivo sin suelo. A lo largo de este artículo comprobaremos cómo la modificación del ambiente (uno de los vértices del triángulo de la enfermedad propuesto por Vanderplank) no conduce a la solución del problema, sino que construye un nuevo triángulo de la enfermedad con vértices distintos.
Los patógenos de los cultivos sin suelo
Qué duda cabe de que los parásitos que afectan a las zonas aéreas de los vegetales son los mismos, ya se trate de un sistema de cultivo con suelo o sin él. Es en aquellos patógenos que tienen su origen en el suelo en los que habremos de detenernos (y a ellos nos referiremos al hablar en el artículo de patógenos en general), y observar si la alteración ambiental introducida al evitar el suelo, tiene un efecto sobre la componente parasitaria del patosistema.
Es cierto que en los análisis de plantas procedentes de cultivo sin suelo, se han encontrado a multitud de agentes patógenos de origen telúrico (Cuadro 1).

Cuadro 1. Agentes infecciosos aislados de raíces de plantas procedentes de cultivo sin suelo.
Pero la importancia económica de las enfermedades por ellos provocadas no resulta, en muchos casos, más que insignificante. La mayoría de los patógenos de relevancia en cultivo sin suelo, pertenecen al orden de los Oomicetos (Clase MASTYGOMYCOTINA, Reino CHROMISTA), y están caracterizados por poseer esporas asexuales nadadoras, llamadas zoosporas. Es esta cualidad la que los vuelve tan peligrosos en un medio de cultivo basado en la circulación de agua. Las zoosporas son producidas en unos cuerpos fructíferos denominados esporangios, que pueden contener decenas de zoosporas (100 zoosporas en el caso particular de Plasmopara lactucaeradicis).
Se estima que en un solo centímetro de raíz de lechuga infectada por este oomiceto puede haber 40 esporangios. Si consideramos que la longitud total de las raíces de una misma lechuga alcanza 20 metros, nos podemos hacer una idea del poder explosivo de propagación de estos seres: 8 millones de zoosporas por planta. Se conoce que una zoospora mantiene su capacidad de movimiento durante 24 horas. Una vez que sale del esporangio, si hay agua libre en el medio (en cultivos sin suelo es así), localiza una raíz mediante quimiotactismos, hasta que la penetra e infecta.
Si las condiciones son las óptimas, esto tiene lugar en 5 minutos. Una vez dentro del tejido radical, el "hongo" vegeta se reproduce asexualmente. Volvemos a tener una zoospora de neogénesis en menos de 12 horas, dependiendo de la especie de oomiceto y de las condiciones en el ambiente suelo. En el sudeste español, los zoosporangiados patógenos más importantes en las explotaciones de cultivo sin suelo son los siguientes:
Phytophthora parasitica en tomate. Produce una pudrición radicular que viene acompañada del decaimiento de las plantas en las horas centrales del día (en el campo se comenta entonces que las matas están "afligidas"). Posteriormente se observa un necrosamiento de la base del tallo, que asciende unos centímetros por el mismo, hasta la muerte de la planta (Foto1).

Foto 1. Síntomas de Phytophthora parasitica.
Pythium aphanidermatum en pepino y melón. La sintomatología mostrada consiste en una necrosis del hipocotilo, acompañada o no de de podredumbre, y necrosis del sistema radicular, que en ocasiones parece ocasionar la marchitez y muerte de las plantas.
Pythium irregulare y Pythium dissotocum en pepino. Los síntomas son los mismos que en P. aphanidermatum, si bien la necrosis del hipocotilo no se manifiesta nunca en las inoculaciones.
Olpidium bornovanus en melón. Este quitridiomiceto es el vector del MNSV (Foto 2).
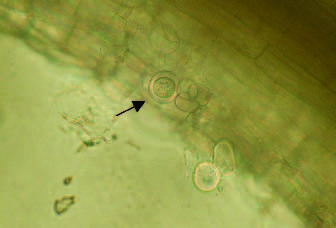
Foto 2. Quiste de Olpidium bornovanus en raíz de melón.
Su papel como transmisor del virus no lo excluye de provocar unos síntomas característicos en la planta de melón. Estos son una podredumbre que oscila de color crema a marrón en las raíces, acompañada a veces de necrosis en el hipocotilo. Cuando el virus del MNSV está presente junto a O. bornovanus, la manifestación de la virosis es diferente a cuando el virus se inocula mecánicamente. En el primer caso, el síntoma principal es una necrosis del hipocotilo, mientras que cuando el virus va solo, el síntoma principal es el cribado (manchitas necróticas) de las hojas. Por otro lado, el papel de Olpidium en el síndrome del colapso o muerte súbita del melón parece ser importante (GÓMEZ, 2003).
En cuanto a patógenos fúngicos, no zoosporangiados, encontramos dos géneros de verdadera importancia en la zona, que ya en cultivos con suelo requieren nuestra atención:
Fusarium oxysporum f. sp. lycopersici. Afecta vascularmente a las plantas de tomate (Fotos 3 y 4).
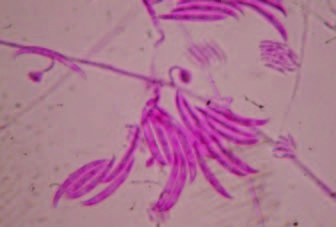
Foto 3. Macroconidios de Fusarium oxysporum.

Foto 4. Necrosis vascular causada por F. o. f. sp. lycopersici.
Ocasiona marchitamiento acompañado de clorosis foliares que tienen su inicio en las hojas basales, y pueden ser unilaterales. Generalmente afecta en meses cálidos.
Fusarium oxysporum f. sp. melonis. Fusariosis vascular que puede inducir dos tipos de síntomas. Por un lado un marchitamiento en verde, y por otro unas clorosis foliares generalizadas en todo el limbo (Foto 5).
En Almería se ha observado cómo previamente a la clorosis, las hojas adquieren un brillo verde acentuado. Otro síntoma característico es la estría necrótica del tallo, que normalmente comenzaba en el hipocotilo y ascendía por el tallo, también se ha visto exteriorizándose a 50 cm sobre el nivel del suelo (GÓMEZ, 2003).

Foto 5. Síntoma de clorosis en melón causada por F. o. f. sp. melonis.
Fusarium oxysporum f. sp. radicis-lycopersici. Se produce un marchitamiento irreversible, generalizado a toda la planta, que se combina o no con un amarilleamiento de las hojas basales. En otras ocasiones la planta amarillea por completo, deteniendo su crecimiento, pero sin llegar a morir. Se producen podredumbres de color marrón en el sistema radicular de la planta, que en el caso más extremo implican en su totalidad las raíces principal y secundarias.
En ocasiones, la epidermis de la raíz principal no se ve dañada, aunque la médula presente una podredumbre húmeda de intenso color marrón (Foto 6).

Foto 6. Síntoma de F. o. f. sp. radicis-lycopersici.
Esta podredumbre puede ascender por el xilema hasta 50 cm de altura. Además, suelen aparecer necrosis en la epidermis de cuello y tallo, que pueden rodearlos, e incluso ascender hasta la copa de la planta (TELLO Y LACASA, 1988).
Fusarium oxysporum f. sp. radicis-cucumerinum. Se desarrolla una podredumbre del cuello y más tarde hipocotilo, usualmente en un lado del tallo, que varía en color del verde muy claro al ámbar o marrón. Progresivamente, la podredumbre del hipocotilo se hace más importante y un crecimiento fúngico blanco puede aparecer en los tejidos infectados. Se observa una podredumbre de la raíz principal y de varias raíces secundarias, mostrando la parte basal del tallo una coloración vascular marrón.
Las plantas con estos síntomas presentan un escaso crecimiento, marchitez, llegando a morir a las pocas semanas. Algunas plantas también pueden marchitarse repentinamente y morir antes de que se observe la podredumbre del hipocotilo (VAKALOUNAKIS, 1996).
Verticillium dahliae en tomate. Síntomas idénticos a los de la fusariosis vascular, con la salvedad de que la enfermedad se manifiesta en la estación fría (Foto7).
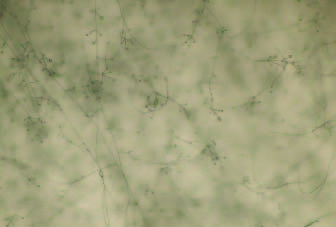
Foto 7. Verticilios con falsas cabezas de Verticillium dahliae.
En menor medida, también Rhizoctonia solani y Chalara elegans han mostrado algunos daños, en ocasiones puntuales. El primero de ellos como patógeno de plántulas y plantas con hasta tres hojas verdaderas. C. elegans sobre plantas adultas en plena producción, ocasionando una necrosis radicular y de la base del tallo y provocando la muerte de las planta (GÓMEZ, 2003).
Una mención particular merecen aquellos parásitos que afectan a los cultivos, exclusivamente en los sistemas sin suelo, sin manifestar su patogeneicidad en cultivos en suelo. En la lechuga y espinaca en hidropónico, existe una grave enfermedad producida por el mismo microorganismo que causa el mildiu en la vid (Plasmopara vitícola), que se ha dado en llamar Plasmopara lactucae-radicis. Cuando este "hongo" infecta a las plantas no muestra pudrición alguna en la raíz.
La única forma de detectar su presencia es comparando plantas enfermas con plantas sanas, pues las primeras padecen un retraso en el crecimiento respecto de las sanas. Este diagnóstico no es posible en un sistema donde la homogeneización del sustrato y del material vegetal son absolutas. Así, al encontrar en una explotación comercial a todas las plantas con un mismo tamaño, nos será imposible determinar la enfermedad (STANGHELLINI Y RASMUSSEN, 1994).
La singularidad de esta enfermedad estriba en que esta interacción lechuga-Plasmopara nunca ha sido presenciada en cultivo en suelo. Es decir, sólo en un ambiente hidropónico se manifiesta la enfermedad.
Phytophthora cryptogea es también un patógeno que presenta esta peculiaridad. Sólo se ha encontrado parasitando a las hortalizas de hoja en sistemas de cultivo hidropónico, sin haberse descrito tal enfermedad en campo abierto (STANGHELLINI Y RASMUSSEN, 1994). Más reciente es la última noticia de una patogénesis exclusiva de los sistemas sin suelo. Se trata de Phytophthora infestans en tomate (Fotos 8 y 9), que sin generar síntomas de la enfermedad en los foliolos ni en el tallo por encima de la zona basal, provoca lesiones marrones oscuras en las raíces de la planta, además de manchar de color marrón el tejido interno de la base del tallo, incluyendo el tejido vascular (LIEVENS, HANSEN, Y VANACHTER, 2004). Esta sintomatología nueva, inducida por el mildiu de la patata, nunca se ha observado en tomates cultivados sobre suelo, mientras que ya ha sido descrita en cultivo con lana de roca.
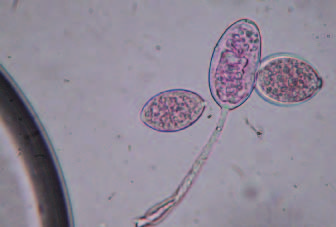
Foto 8. Esporangios de Phytophthora infestans.

Foto 9. Mildiu en fruto de tomate.
Fuentes del inóculo patógeno en los cultivos sin suelo
A) El agua.
A través del riego encuentran los patógenos acuáticos su mejor medio de dispersión. Esta agua de riego puede venir contaminada, sobre todo si aguas arriba existen cultivos semejantes al de nuestra explotación. Las canalizaciones descubiertas, así como las balsas mal aisladas pueden acoger a cualquiera de estos patógenos con suma facilidad (GÓMEZ, 2003). También podemos encontrarlos en el agua acumulada en el techo de los invernaderos, o en los equipos de pulverización, sin olvidarnos de las salpicaduras. Debemos anotar el hecho de que en los sistemas recirculantes en los que aparezcan problemas del tipo de los aquí tratados, el agua será una fuente continua de inóculo, que tendremos que controlar sin descanso.
B) El aire.
Con las altas densidades de cultivo en que nos movemos en el Sudeste español, y con las numerosas horas de viento que este clima nos regala, cualquier espora de Fusarium oxysporum patógena para nuestro cultivo, procedente de alguna explotación vecina, se puede instalar en nuestro sustrato sin muchos inconvenientes.
C) El suelo.
Si nuestro suelo contenía propágulos de algún agente patógeno, previamente a la implantación del cultivo sin suelo, estos pueden permanecer durante varios años en el mismo. Con cualquier movimiento que levante el polvo del suelo, estaremos exponiendo nuestro sustrato o película nutritiva a la invasión del patógeno. Incluso tapando el suelo con alguna malla o plástico, el suelo será un potencial de inóculo.
D) Semillas y plantones.
Aquellas semillas infectadas por una bacteria, virus u hongo. En concreto se ha estudiado a Clavibacter michiganensis subsp. michiganensis y los virus MNSV y ToMV, pueden permitir la rápida difusión de los patógenos a través del agua (bacteria y Olpidium bornovanus para MNSV) o por contacto (ToMV) (STANGHELLINI Y RASMUSSEN, 1994). Si el sustrato lo mantenemos varias campañas, las raíces que permanecen en los sustratos pueden ser transmisoras de virus por contacto. La misma mención merecen las plantas procedentes de los semilleros.
E) Las labores culturales.
Podas, aclareos, recolecciones, trasiego de personal de unas explotaciones a otras, son también claras fuentes de inóculo.
F) Sustratos.
Deben llegar al agricultor esterilizados, pero a menudo el transporte o un deficiente manejo permiten la colonización por patógenos (GRAHAM Y TIMMER, 1991).
G) Insectos.
Se ha comprobado cómo las moscas Bradysia spp. y Scatella stagnalis, habitantes comunes de los sustratos, pueden ser vectores de diversos patógenos como Pythium aphanidermatum, Fusarium oxysporum f. sp. radicis-lycopersici y de Chalara elegans. Esta vectorización puede suceder por dos vías: a través de adultos que ingieren esporas que posteriormente excretan sobre material sano, y a través de larvas que ingieren esporas que permanecen dentro del insecto hasta que se transforma en un adulto que excretará el propágulo (STANGHELLINI Y RASMUSSEN, 1994).
Métodos de control
Una vez que el patógeno se ha instalado en nuestro cultivo, difícilmente podremos eliminarlo. No obstante, existen métodos que nos ayudarán a controlar hasta cierto punto la enfermedad en algunos casos.
A) Métodos culturales
- Imprescindible es la elección de un buen material de siembra o plantación. Este material tendrá que estar sano, libre de patógenos. Debemos procurar trabajar con variedades resistentes, si bien sería lo más conveniente alternar variedades con diferentes genes de resistencia para evitar el establecimiento de patotipos virulentos en el cultivo.
- Las herramientas de trabajo han de ser desinfectadas con lejía o fosfato trisódico.
- Es aconsejable tener un pediluvio con una solución desinfectante a base de sulfato de cobre a la entrada del invernadero (MARTÍNEZ Y DURÁN, 2000).
- Intentar que las balsas para riego estén tapadas.
- Tratar la solución nutritiva con métodos como filtración o irradiación ultravioleta.
B) Métodos biológicos. El establecimiento de antagonistas en los sustratos inertes no es tarea sencilla, debido a los requerimientos saprofitarios de estos microorganismos. En la actualidad se están evaluando diversas compostas como sustrato para cultivo sin suelo. Estos materiales, ricos en materia orgánica descompuesta y semidescompuesta, son ideales para el establecimiento de estos agentes de control biológico. No en vano, ya de por si, estas compostas contienen un número importante de microbios antagonistas sin necesidad de inoculación previa.
Por tanto, la reutilización de sustratos, supone, además de una solución para la gestión de residuos, una alternativa saludable a los actuales sustratos inertes (HOITINK, INBAR, BOEHM 1991).
C) Métodos químicos.
La aplicación de fungicidas de síntesis presenta cuatro problemas: Pueden provocar depósitos y atascos en los emisores, generalmente tienen plazos de seguridad demasiado altos para la frecuencia de recolección de muchas hortícolas, resultan fitotóxicos a las dosis que son eficaces como fungicidas en las técnicas de película nutritiva, y nada nos exime de inducir la aparición de resistencias.
En cuanto al tratamiento con cloro, se recomienda el tratamiento de las balsas de riego (sólo si son de pequeño tamaño y están cubiertas) con hipoclorito sódico a dosis de 5 a 7 ml · L-1. Se puede aplicar la lejía también mediante una "bomba de hipoclorito", directamente al agua de riego, pero su calibración es muchas veces incorrecta y el procedimiento resulta inútil.
A modo de conclusión
Cuando analizamos la raíz de una planta cultivada procedente de un suelo, encontramos una gran diversidad microbiana asociada a la misma. Entre estos microorganismos se hallan multitud de especies que tienen que competir por un mismo nicho ecológico con los agentes patógenos de los cultivos. Vemos cómo el suelo es un soporte dinámico, con multitud de variables de tipo biológico que van a determinar el porvenir de la rizosfera de nuestras plantas.
En un sustrato o en una solución nutritiva de un cultivo sin suelo, esa microbiota es totalmente diferente. Inicialmente nos encontramos ante un soporte inerte, desinfectado, prácticamente vacío, y con unas condiciones físico-químicas que se presuponen ideales para el cultivo. Pero también ideales para el establecimiento de algunos microorganismos patógenos. Y lo que parece más sorprendente, también para la manifestación de enfermedades que en los cultivos en suelo nunca se han observado.













